Come il live-imaging ha rivoluzionato la microscopia
Introduzione
Se vi è mai capitato di osservare un video di una popolazione cellulare, sicuramente sarete rimasti sbalorditi da come processi biologici all’apparenza statici siano in realtà estremamente dinamici ed eterogenei. I sistemi biologici infatti si basano su complesse interazioni tra innumerevoli componenti cellulari che avvengono nelle 3 dimensioni dello spazio e nel tempo. Di conseguenza, avere una visione d’insieme è essenziale per lo studio delle dinamiche spazio-temporali di questi processi.
Tuttavia una tale completezza si rivela spesso difficile da raggiungere. Le tecniche di microscopia tradizionali infatti prevedono l’utilizzo di campioni fissati, i quali forniscono statiche istantanee (“snapshots”) della realtà in precisi e determinati istanti. Appare dunque evidente che le tecniche di imaging classico non permettono di ottenere un quadro completo del processo in analisi, ed è qui che il live-cell imaging si afferma come una valida soluzione.

I fotogrammi dell’esperimento di Julius Ries, primo esempio documentato di Live-Cell Imaging. Nello specifico, è possibile osservare lo sviluppo embrionale di un riccio di mare.
Uno dei primi a sperimentare questo approccio fu Julius Ries nel 1907, il quale decise di filmare lo sviluppo embrionale di un riccio di mare. Il Professor Ries riteneva disegni e sezioni fissate non adeguati all’insegnamento dell’embriologia, dunque fotografò a intervalli regolari il processo lungo un arco temporale di circa 14 ore, per poi mostrarlo ai suoi studenti in una sequenza di 2 minuti (Figura 1). Questa modalità di rappresentazione accelerò i movimenti microscopici delle divisioni cellulari, rendendo il processo visibile e apprezzabile per gli studenti. Da quel giorno la microscopia e le tecniche di time-lapse si sono chiaramente evolute e oggi esistono molteplici soluzioni, ognuna coi suoi punti di forza e con le sue limitazioni. In questa application note analizzeremo le principali tecniche di live-cell imaging (Figura 2), dalle più convenzionali (Luce trasmessa, widefield e confocale) alle più innovative (Olotomografia di Nanolive e confocale laser-free di Aurox).

Come fare Live-Cell Imaging?
Il live-cell imaging è un’ottima strategia per ottenere informazioni sulle dinamiche cellulari, ma allo stesso tempo difficile da realizzare. L’ostacolo principale è rappresentato dalla salute delle cellule; mantenere le cellule in buone condizioni sotto il microscopio è infatti essenziale per ottenere video di qualità senza compromettere la veridicità dei dati. Di conseguenza, il live-cell imaging è un delicato compromesso tra qualità dell’immagine e salute delle cellule.
Per proteggere i campioni biologici non solo è necessario mantenere stabili i parametri di temperatura, CO2 e umidità, ma è anche molto importante ridurre al minimo i danni da fototossicità. Oltre a un incubatore opportuno, è infatti essenziale limitare la produzione di ROS (Reactive Oxygen Species) dovuta all’eccessiva eccitazione dei campioni fluorescenti. A tal fine, la selezione di fonti luminose adatte, detector ad alta sensibilità (high signal/noise ratio) e protocolli con intensità e frequenze di acquisizione ottimizzati diventa determinante per la buona riuscita dell’esperimento di live-cell imaging. Video ad alta risoluzione richiederanno strumentazioni potenti (forti eccitazioni), ma dannose per le nostre cellule, viceversa, video con minor qualità (deboli stimolazioni o assenza di fluorescenza) ci permetteranno di registrare le cellule per tempi più lunghi senza comprometterne la salute (Figura 3).
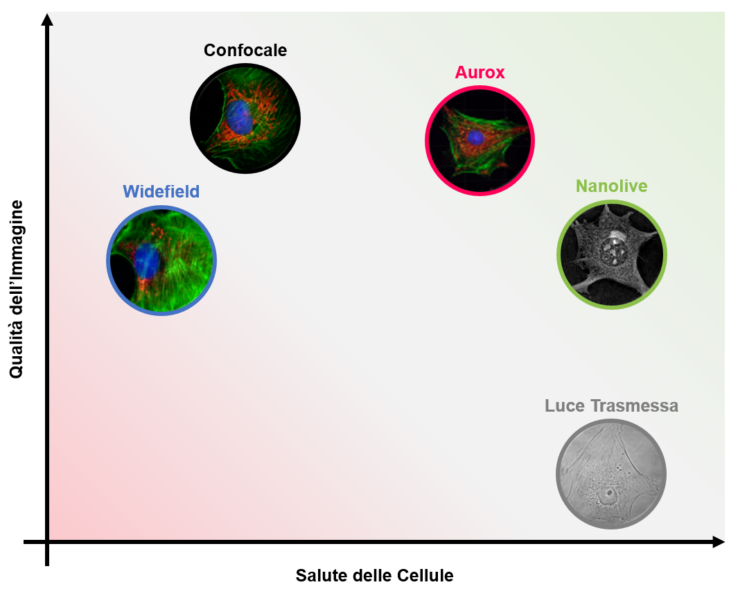
Il live-cell imaging è un delicato compromesso tra qualità dell’immagine e salute delle cellule. Tecniche di microscopia convenzionali privilegiano un parametro a scapito dell’altro, mentre Aurox e Nanolive rappresentano un bilanciato compromesso.
Utilizzando microscopi a fluorescenza widefield o confocale siamo in grado di ottenere immagini di ottima qualità, ma phototoxicity e photobleaching [1] rimangono i principali limiti di queste tecniche. Per quanto l’utilizzo di laser e sistemi confocali abbia ridotto notevolmente i danni da fototossicità rispetto ai sistemi widefield, i confocali rimangono strumenti limitati per il live-cell imaging, ma ottimi se si necessitano video ad alta risoluzione (Figura 3).
D’altro canto, le immagini generate da un classico microscopio a luce trasmessa non sono caratterizzate da un alto contrasto o risoluzione, ma le fonti luminose utilizzate e l’assenza di fluorescenza consentono la totale eliminazione della fototossicità. La microscopia a luce trasmessa rappresenta dunque un’ottima soluzione per ottenere video prolungati quando non si necessita di alta qualità dell’immagine (Figura 3).
Anche nel caso di Nanolive la fototossicità è totalmente eliminata grazie all’utilizzo di fonti luminose “gentili”. A differenza della microscopia a luce trasmessa però, Nanolive è in grado di ottenere immagini in 3D ad altissima risoluzione (200nm) e ad altissime velocità (0,5fps) combinando l’olografia e la tomografia. L’unione di queste due tecniche permette la mappatura 3D dell’indice di rifrazione del campione senza l’utilizzo di marcatori o staining, creando un ottimo compromesso tra qualità dell’immagine e salute delle cellule.
Immagini e video di alta qualità possono essere ottenuti anche con Aurox. Come descritto in Figura 2, Aurox consiste in un confocale spinning disk che non utilizza laser, bensì LED. L’implementazione di questa tipologia di fonte luminosa permette una notevole riduzione dei danni da fototossicità, senza particolari implicazioni sulla qualità dell’immagine. Anche Aurox dunque rappresenta un’ottima strategia per il live-cell imaging nonostante l’utilizzo della fluorescenza.
User-Friendly non è un optional
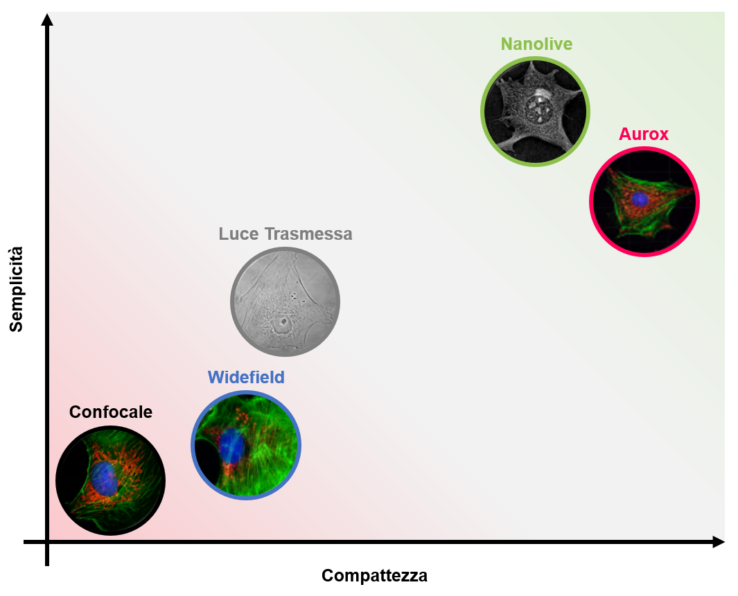
Gli esperimenti di live-cell imaging sono difficili da realizzare. Per tanto, la semplicità e la compattezza di Nanolive e Aurox rappresentano un notevole vantaggio rispetto agli approcci tradizionali.
Come anticipato precedentemente, il live-cell imaging è un equilibrio tra image quality e cell wellness, ma questi parametri non sono gli unici criteri da tenere in considerazione. In un mondo dove la tecnologia evolve velocemente producendo strumenti sempre più complessi sia dal punto di vista hardware che software, parametri come compattezza e semplicità non sono da sottovalutare. I sistemi tradizionali (luce trasmessa, widefield e confocale) sono generalmente strumenti ingombranti, composti da più componenti, solitamente collocati in stanze adibite e utilizzati da più utenti con differenti esigenze sperimentali (Figura 4).
I microscopi Aurox e Nanolive invece sono caratterizzati da una struttura molto compatta di dimensioni ridotte, posizionabili direttamente sul bancone di lavoro e dedicati al live-cell imaging (Figura 4). Queste caratteristiche semplificano notevolmente le attività dell’operatore, offrendogli la possibilità di collocare gli strumenti direttamente nelle cell culture room riducendo gli spostamenti del campione. Infine, anche sul lato software i microscopi Nanolive e Aurox sono controllati e monitorati da programmi con interfacce semplici e intuitive, che permetto la pianificazione, acquisizione e revisione dell’esperimento live-imaging in brevissimo tempo (Figura 4). Nell’insieme, queste caratteristiche rendono Nanolive e Aurox strumenti ottimali per la microscopia time-lapse.
..and the winner is…
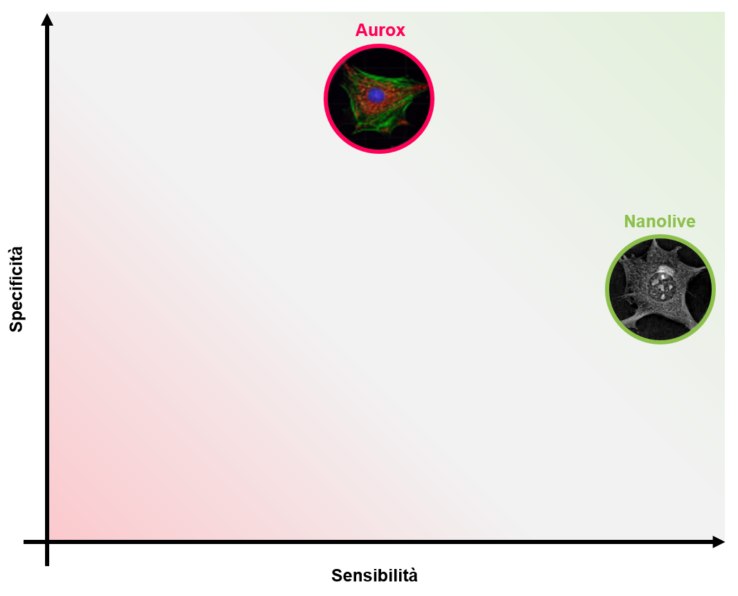
Nanolive e Aurox sono tecnologie complementari. Mentre Nanolive fornisce video ad alta sensibilità, Aurox permette l’ottenimento di immagini ad alta specificità.
È lecito a questo punto domandarsi quale sia il miglior strumento per il live-cell imaging. Aurox o Nanolive? Senza dubbio entrambe le tecnologie presentano ottime caratteristiche per la microscopia time-lapse come abbiamo evidenziato nei paragrafi precedenti.
Ad ogni modo, questi microscopi si basano su due tecnologie totalmente differenti. Mentre Aurox consiste in un’evoluzione del sistema a fluorescenza confocale spinning disk, Nanolive utilizza l’olotomografia per mappare l’indice di rifrazione del campione. Di conseguenza le immagini, e dunque i video, ottenibili con questi due microscopi sono del tutto dissimili: se con Aurox sarà possibile visualizzare con alta specificità gli staining di proteine d’interesse, Nanolive d’altro canto fornirà un’immagine globale della cellula ad altissima sensibilità e definizione (Figura 5). Allo stesso tempo, Aurox permette di visualizzare solamente i componenti cellulari marcati con fluorescenza, mentre l’olotomografia non consente di seguire con precisione eventuali proteine d’interesse [2]. In altre parole, nessuna di queste due tecnologie prevale sull’altra, al contrario, risultano complementari potendo compensare l’una i limiti dell’altra.
Sfortunatamente, ad oggi non esiste un’unica soluzione di microscopia in grado di rispondere a tutte le esigenze scientifiche, ma l’accoppiata Nanolive-Aurox, rappresenta una potente e completa strategia user-friendly per il live-cell imaging.
2] Per completezza, è opportuno sottolineare che Nanolive può essere integrato con un sistema a fluorescenza widefield LED. Ciò permette di seguire elementi biologici d’interesse, ma di conseguenza introduce tutti i limiti della fluorescenza tradizionale precedentemente descritti.



