Quantificare gli effetti di un determinato farmaco è un processo fondamentale e comunemente praticato dalle case farmaceutiche o istituti di ricerca. La potenza di un farmaco viene definita con l’EC50 (Half maximal effective concentration), ovvero la concentrazione tale per cui si ottiene la metà dell’effetto massimo. Di conseguenza, a parità di meccanismo d’azione, un farmaco è tanto più potente quanto minore la sua EC50. Valutare la performance di un farmaco non è un processo semplice e inoltre recenti studi hanno sollevato dubbi riguardo la robustezza e riproducibilità del parametro EC50. Infatti, le EC50 calcolate con i metodi attuali mostrano variabilità importanti mettendo in dubbio la validità del dato. Una strategia per calcolare l’EC50 è il dose-dependent cell death assay, test nel quale concentrazioni crescenti vengono testate in vitro e valutate osservando gli effetti a livello cellulare (es. morte cellulare). Attualmente, gli studi più comuni si basano su test luminometrici oppure fluorometrici. Il problema principale legato a queste strategie end-point è che necessitano di essere ripetute più volte per testare tutte le concentrazioni e timepoints, processo costoso sia dal punto di vista dei reagenti che del tempo impiegato. Inoltre, è risaputo che l’utilizzo della fluorescenza produce danni al campione mettendo a rischio la validità dell’EC50 calcolata.
Una soluzione a questi problemi è rappresentata da test label-free nei quali nessun marcatore viene utilizzato e quindi ogni possibile bias viene eliminato. Un esempio di imaging label-free è l’olotomografia di Nanolive, tecnologia che permette di visualizzare cellule in vitro in time-lapse e senza fluorescenza. Questo microscopio innovativo non solo permette di ottenere EC50 validi e riproducibili, ma consente l’imaging continuo del campione nel tempo, riducendo notevolmente costi e tempistiche, e aumentando la precisione dell’EC50 calcolata (Figura 1). Infatti, la possibilità di monitorare il campione durante tutta la durata dell’esperimento permette di calcolare anche la cinetica dell’EC50, verificando la stabilità del farmaco nel tempo (se la sua potenza aumenta o diminuisce col passare del tempo).
Un esempio di dose-dependent cell death assay è riportato in un’application note di Nanolive, nel quale viene calcolata l’EC50 della Clorochina su cellule HeLa. La Clorochina è un farmaco già impiegato nella prevenzione e trattamento della malaria e agisce bloccando l’autofagia (processo cellulare essenziale attraverso il quale la cellula rimuove componenti citoplasmatici danneggiati). Una volta piastrate, le cellule sono state trattate con concentrazioni crescenti di Clorochina (0 µM, 25 µM, 50 µM, 100 µM, and 200 µM) e visualizzate con Nanolive CX-A (https://www.nanolive.ch/products/3d-microscopes/cx-a/) per 60 ore con una frequenza di acquisizione di 15 minuti (Figura 2).
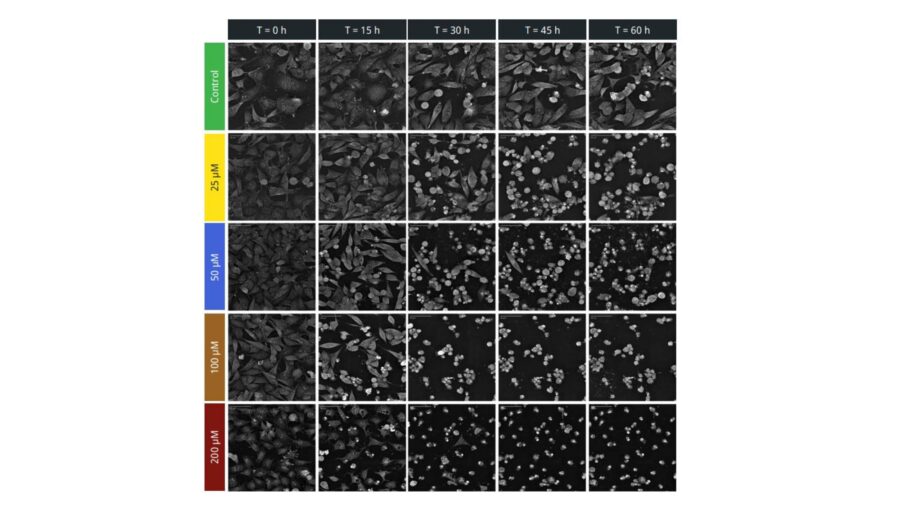
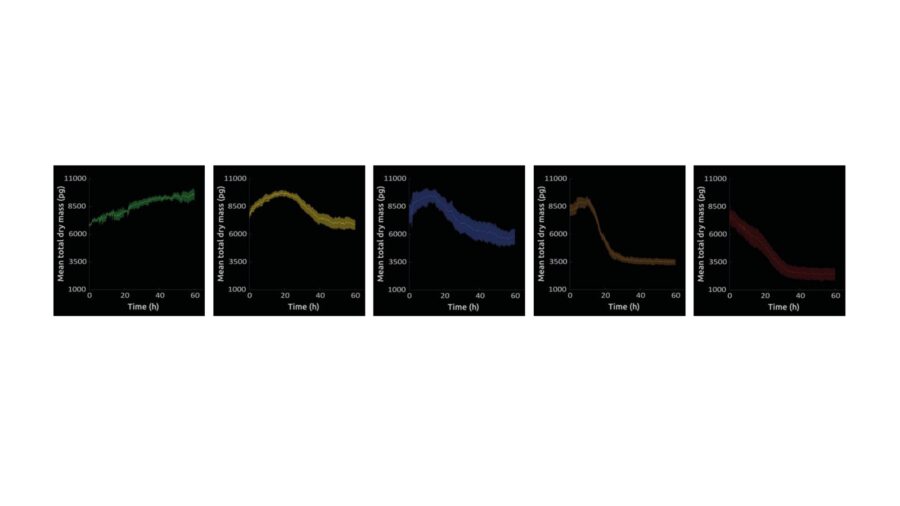
Ma una volta ottenuti questi video, come li trasformiamo in risultati? Fortunatamente Nanolive è dotato di un software in grado di analizzare semi-automaticamente i video prodotti fornendo 13 parametri riguardo composizione, morfologia e popolazione cellulare (https://www.linkedin.com/feed/update/urn:li:activity:6986317579829030912/). Oltre a parametri standard come area, perimetro o numero di cellule, Nanolive è in grado di raccogliere informazioni riguardo il contenuto cellulare. Grazie all’olotomografia infatti, Nanolive ottiene una mappatura dell’indice di rifrazione della cellula: tale informazione permette al software di quantificare precisamente il contenuto cellulare con il parametro Dry Mass. La “massa secca” si riferisce a tutti i componenti cellulari (macromolecole) esclusa l’acqua e risulta un eccellente parametro per monitorare la salute delle cellule. Infatti, la dry mass è correlata sia ai processi anabolici che degradativi e permette all’operatore di comprendere immediatamente l’andamento della popolazione cellulare. Per esempio, in figura 3 è possibile notare l’andamento della dry mass nell’esperimento descritto in figura 2. Mentre nei pozzetti di controllo (n=5) la dry mass cresce nel tempo (proliferazione cellulare e anabolismo comportano ad un aumento del parametro), nei 4 trattati il valore decresce con tempistiche differenti. Grazie al continuous imaging di Nanolive è infatti possibile registrare con precisione le dinamiche di mortalità cellulare e dunque migliorare notevolmente i dose-dependent cell death assay.
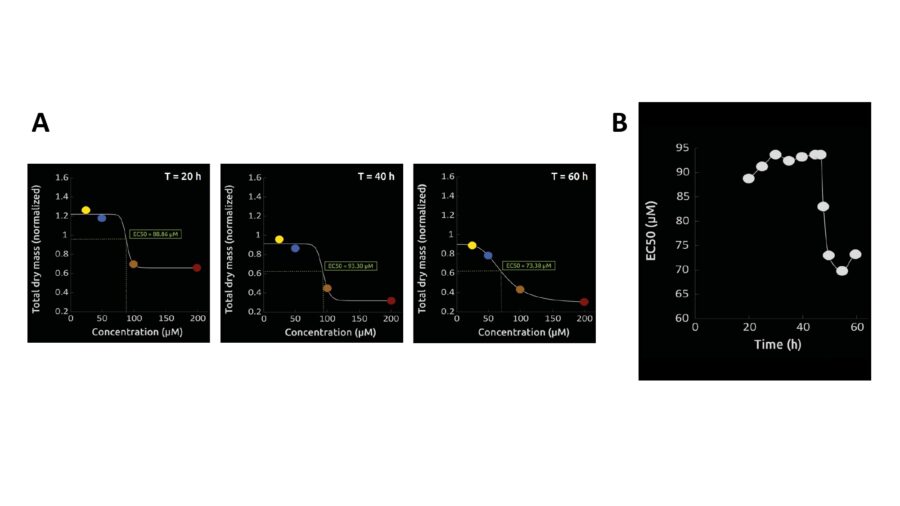
Per concludere, in figura 4 è raffigurato il calcolo dell’EC50 dell’esperimento analizzato. EC50 è un parametro che varia nel tempo dunque viene calcolato a più timepoints: in questo caso sono stati selezionati 11 timepoints (intervalli da 5 ore a partire dalla prima morte cellulare registrata). In figura 4A è riportato il calcolo di 3 timepoints sfruttando il parametro dry mass, mentre in figura 4B viene graficata l’EC50 nel corso del tempo.
È evidente che l’EC50 della Clorochina decresce nel tempo e ciò indica che il composto ha un maggiore effetto over time e dunque un effetto cumulativo sulla morte cellulare. Al contrario, un’EC50 che aumenta nel tempo avrebbe suggerito una certa instabilità del composto, il quale perde potenza con il passare del tempo.