Nelle neuroscienze gli studi in vivo rappresentano un approccio sperimentale essenziale e insostituibile. La complessità del sistema nervoso rende impossibile la riproduzione di tale sistema in vitro, pertanto l’utilizzo di animali modello è inevitabile. Gli esperimenti in vivo infatti consentono di osservare e valutare strutture e funzionalità dei tessuti nervosi in un contesto fisiologico o patologico. D’altro canto però, l’utilizzo di organismi comporta inevitabili scomodità. Oltre ai costi elevati, il campione vivente richiede una maggiore attenzione e capacità tecnica, sia nella sua gestione sia nella preparazione del campione stesso. Per esempio, l’imaging in vivo di un cervello di topo necessita l’applicazione di una Cranial Window, dispositivo in vetro per l’accesso ottico applicato in sostituzione al cranio attraverso una procedura chirurgica. Tra i metodi di investigazione e valutazione in vivo infatti, ritroviamo la microscopia. In particolare, la microscopia a 2 fotoni rappresenta lo strumento di imaging in vivo per eccellenza, in quanto in grado di penetrare nei tessuti senza danneggiarli.
Una scomodità comunemente riscontrata negli esperimenti di microscopia in vivo è la ricerca della zona d’interesse e la sua messa a fuoco. Navigare all’interno dei tessuti di un organismo vivente è chiaramente un processo molto delicato, soprattutto se l’apparato in questione è il sistema nervoso. In due precedenti articoli abbiamo trattato in dettaglio svariate tecniche per mettere a fuoco l’immagine all’interno dei tessuti cerebrali utilizzando i sistemi Femtonics (FemtonicsFocus1 e FemtonicsFocus2). Un sistema per trovare la zona di interesse invece, è la Green Light, un modulo LED che illumina il campione con una luce innocua, ma che permette di visualizzare i vasi sanguigni in superficie. Per posizionare l’obiettivo in prossimità del cervello dunque, sarà sufficiente ricercare con la Green Light le vene e i capillari dell’organismo, i quali ci indicheranno l’arrivo nella corretta posizione. Da lì, “switchando” sul laser sarà possibile iniziare a penetrare il campione e visualizzare l’immagine a fluorescenza. La Green Light è un modulo opzionale Femtonics, la quale può essere installata sia sul sistema a 2 fotoni convenzionale FEMTO SMART che sull’innovativo FEMTO 3D ATLAS (Femtonics).
Negli esperimenti in vivo è comune la necessità di visualizzare la stessa regione nel corso del tempo, dunque su più giorni in maniera regolare per monitorare un determinato processo. In tal caso, ritrovare la stessa regione corticale può essere difficoltoso. Per quanto la finestra craniale (Cranial Window) guidi l’operatore sempre nella stessa zona, è plausibile supporre che a livello microscopico non ritroveremo la stessa regione corticale. Grazie alla Green light però, l’operatore potrà registrare, e dunque memorizzare, specifici pattern capillari per poi ritrovarli in una seconda occasione. I vasi capillari infatti rappresentano un’ottima “mappa” e possono essere utilizzati per riposizionarsi nella regione d’interesse.
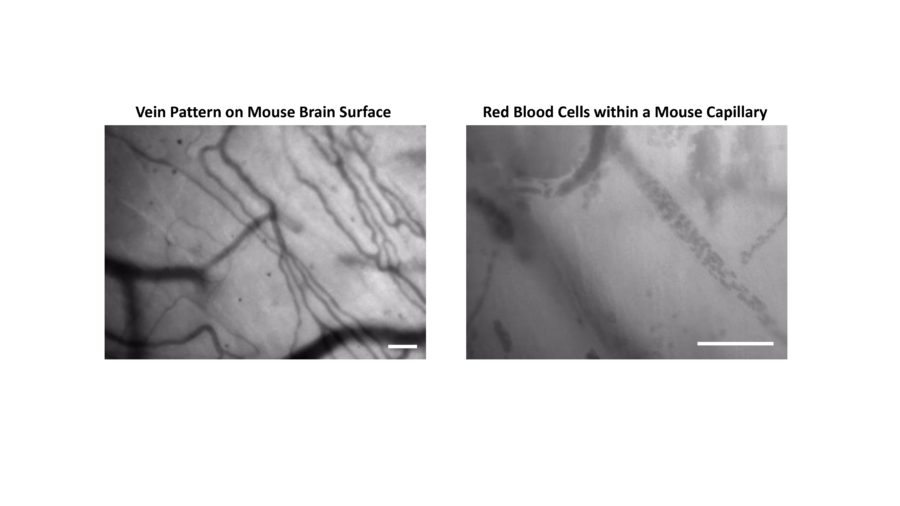
Figura 1: Esempi di immagini ottenute con il modulo Green Light di Femtonics, nelle quali è possibile notare il pattern di vene e capillari, o addirittura i globuli rossi che scorrono al loro interno.
Infine, il Green Light module è utilissimo per esperimenti di elettrofisiologia. Le immagini live ottenute con questa tipologia di illuminazione aiuta l’operatore nel posizionamento della pipetta da patch clamp. Il Patch Clamp è una tecnica utilizzata per la misurazione delle correnti ioniche presenti sulla membrana cellulare e consiste nel posizionamento di una pipetta sulla superficie della cellula (sia coltura cellulare che fettina di tessuto). In tal modo, il lume della pipetta isolerà una specifica area della membrana (e i canali ionici presenti), la quale potrà essere controllata chimicamente o elettricamente ed essere analizzata. Grazie alla Green Light dunque, l’operatore potrà posizionare la pipetta correttamente sia su singole cellule che su tessuti, sia di colture neuronali che di altre tipologie (cardiomiociti, fibre muscolari, ecc.). (Figura 2)