Alternativa alle tecniche “killer” senza usare i marcatori: il live cell imaging
I mitocondri sono complessi organelli deputati alla produzione di energia nelle cellule e responsabili di svariate funzioni come il metabolismo energetico e morte cellulare programmata (apoptosi). È proprio per il loro ruolo centrale nella fisiologia della cellula che i mitocondri sono diventati oggetto di studio molto diffuso nella comunità biologica, dato anche il loro coinvolgimento in innumerevoli patologie degenerative. Di conseguenza, l’analisi dei meccanismi e delle dinamiche mitocondriali risulta essenziale per la comprensione del ruolo di questi organelli nelle cellule e nell’organismo.
La morfologia e la composizione dei mitocondri ne determinano la loro funzionalità. Mentre le analisi biochimiche possono essere utilizzate per determinare la loro composizione, l’osservazione al microscopio può essere usata per valutare la loro struttura, localizzazione e attività all’interno della cellula. L’utilizzo della microscopia per lo studio dei mitocondri avviene principalmente attraverso microscopia elettronica oppure ottica a fluorescenza. Entrambe le tecniche sono caratterizzate da un’alta risoluzione e specificità, ma necessitano l’utilizzo di campioni fissati: tale caratteristica limita fortemente la capacità di questi strumenti nello studio delle dinamiche mitocondriali.
Risulta dunque evidente come la necessità di una visualizzazione dinamica degli organelli richieda l’utilizzo di tecniche di microscopia live-cell imaging. La capacità di monitorare nello spazio e nel tempo i mitocondri in cellule vive permette infatti di ottenere innumerevoli informazioni riguardo la loro morfologia e attività. A questo scopo, nel corso degli ultimi decenni sono stati prodotti numerosi marcatori fluorescenti compatibili con le cellule vive, allo scopo di marcare e seguire i mitocondri all’interno della cellula durante i suoi naturali processi fisiologici.
https://m-s.it/solutions/3d-cell-explorer/
Purtroppo però, la maggioranza di tali coloranti ha effetti citotossici che ne limita fortemente l’utilizzo e l’interpretazione dei dati raccolti. Tale tossicità può avvenire sia a causa della loro struttura molecolare che li porta ad accumulare all’interno dell’organello, sia a causa della produzione di ROS a seguito di un’eccessiva stimolazione UV.
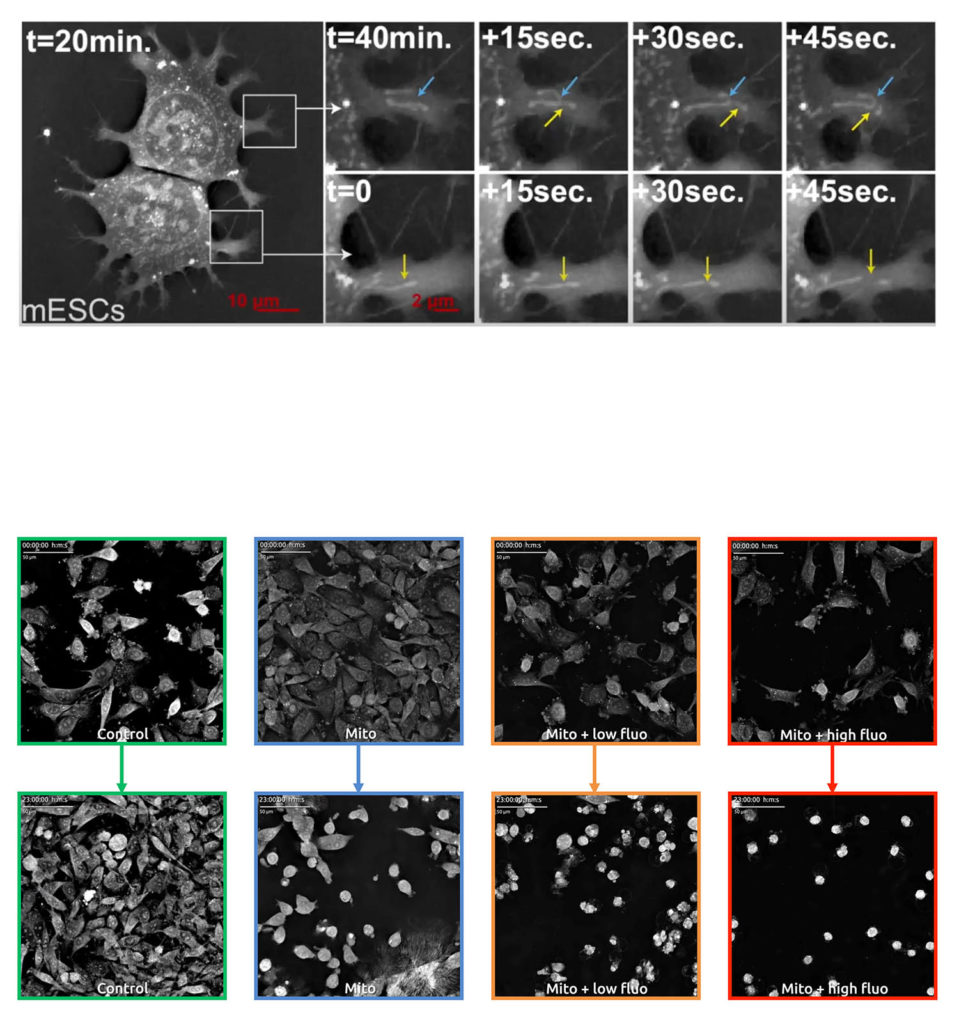
Figura 1: Cellule staminali embrionali di topo. Nei due ingrandimenti di questo frame ottenuto da un video in olotomografia, è possibile notare eventi di Fusione e Fissione mitocondriale. In particolare, le frecce blu indicano il processo di unione tra due mitocondri, mentre le frecce gialle seguono due processi di scissione di mitocondri.
Figura 2: Video olotomografico di pre-adipociti murini incubati e non con Mitotracker. La presenza del colorante comporta mortalità cellulare, la quale accresce in presenza di stimolazione UV.
Una soluzione per evitare danni alle cellule durante il live cell imaging è rappresentata dall’olotomografia. Questa tecnologia permette infatti la mappatura dell’indice di rifrazione del campione, senza l’utilizzo di fluorescenza, e consente di visualizzare organelli (in questo caso, i mitocondri) con alta risoluzione e sensibilità (Figura 1).
A riprova di quanto appena discusso, è possibile osservare quanto accade in Figura 2. Nello specifico, pre-adipociti murini sono stati coltivati con o senza Mitotracker, un marcatore comunemente utilizzato per visualizzare i mitocondri. Inoltre, le cellule marcate con Mitotracker sono state sottoposte o meno a uno stimolo fluorescente di bassa o alta intensità. Risulta evidente dalle immagini proposte che, mentre le cellule del campione di controllo registrate utilizzando solamente l’olotomografia in live cell imaging, rimangono prolifiche e in salute, quelle incubate con Mitototracker subiscono danni più o meno evidenti. Nonostante l’assenza di stimolazione fluorescente, le cellule con Mitotracker mostrano un’importante mortalità. Quando irradiate con UV, le cellule marcate con Mitotracker mostrano un ulteriore aumento di mortalità direttamente proporzionale all’intensità dello stimolo.